Микробиологические методы исследования
ЦЕЛЬ МИКРОБИОЛОГИЧЕСКИХ МЕТОДОВ
Цель микробиологического исследования — установить этиологическую роль тех или иных микроорганизмов при возникшем заболевании или клиническом синдроме. При этом следует учитывать, что возбудителями воспалительных процессов органов репродуктивной системы могут быть как УПМ — представители транзиторного компонента нормальной микрофлоры влагалища и других биотопов, так и абсолютные патогены — возбудители ИППП. Такая связь ИППП и оппортунистических инфекций (вызванных УПМ) определяет необходимость комплексного подхода к микробиологической диагностике.
ПОКАЗАНИЯ
Микробиологические методы исследования используют для подтверждения или исключения заболеваний инфекционной природы.
МЕТОДИКА
ПРАВИЛА ВЗЯТИЯ КЛИНИЧЕСКОГО МАТЕРИАЛА
Отделяемое из уретры берут пластиковой одноразовой стерильной бактериологической петлёй объёмом 1 мкл или тонким дакроновым тампоном на алюминиевой проволоке. Предварительно наружное отверстие уретры следует очистить марлевым или ватным тампоном. При отсутствии видимых выделений врач может выполнить лёгкий массаж уретры. Тампон/петлю вводят в уретру на 1–2 см и вынимают, слегка нажимая на боковые и заднюю стенки. Для микроскопического и иммунофлюоресцентного исследования материал переносят на предметное стекло, прокатывая по нему тампон или передвигая петлю с материалом с лёгким нажимом. Для культурального исследования и ПЦР материал помещают в пробирки с соответствующими транспортными средами.
Наружные половые органы, преддверие влагалища: мазки берут стерильными ватными (дакроновыми) тампонами с патологически изменённых участков; при воспалении большой железы преддверия проводят пункцию, при вскрытии абсцесса железы берут гной стерильным ватным тампоном.
Влагалище: после введения зеркала и подъёмника отделяемое берут стерильным ватным тампоном из заднего свода или с патологически изменённых участков слизистой оболочки; с целью культурального исследования тампон помещают в стерильную пробирку и немедленно отправляют в лабораторию. Если это требование не может быть выполнено, взятую пробу помещают в пробирку с транспортной средой.
С целью микроскопии взятую пробу переносят на предметное стекло, перекатывая тампон всеми сторонами по стеклу, стараясь, чтобы материал распределился равномерно, сохраняя естественное взаиморасположение всех компонентов биоценоза; мазок высушивают на воздухе, фиксируют 96% раствором этанола (2–3 капли на мазок до полного испарения), маркируют стекло и в закрытой ёмкости отправляют в лабораторию. При культуральной диагностике трихомониаза взятое отделяемое сразу помещают в питательную среду и транспортируют в лабораторию.
Шейка матки: после обнажения шейки матки в зеркалах влагалищную часть её тщательно обрабатывают ватным тампоном, смоченным стерильным 0,9% раствором натрия хлорида или водой, затем стандартный ватный тампон осторожно вводят в шеечный канал, берут отделяемое, вынимают тампон, не касаясь стенок влагалища, и помещают его в пробирку с транспортной средой для проведения культурального исследования. Для выполнения микроскопии методом иммунофлюоресценции в различных модификациях, вирусологического исследования или ПЦР материал берут специальным тампономщёточкой, который вводят в канал после удаления слизистой пробки или взятия пробы на культуральное исследование. После введения тампонащёточки в цервикальный канал на 1–2 см его вращают несколько раз, чтобы получить клеточный соскоб, но не допуская скарификации и попадания элементов крови на тампон. Взятый материал помещают в пробирки с соответствующей транспортной средой. Для микроскопического и иммунофлюоресцентного исследования взятую пробу сразу переносят с тампона на предметное стекло.
Матка: материал из полости матки для исследования может быть получен только при использовании специального устройства, имеющего наружное покрытие на шприцеаспираторе. Соблюдая правила асептики, проходят цервикальный канал и в полости матки раскрывают наружную оболочку шприца, после чего аспирируют содержимое. После этого закрывают наружную оболочку и вынимают зонд из матки.
Придатки матки: материал из очага инфекции можно получить только при оперативном вмешательстве (гной, экссудат, биопсийный материал) или при проведении диагностической пункции опухолевидных образований в малом тазу, проводимой через влагалищные своды (следует учитывать возможность контаминации пробы влагалищной микрофлорой). В некоторых случаях, если очаг инфекции в придатках матки сообщается с полостью матки, могут быть полезными повторные исследования отделяемого цервикального канала при однотипности результатов исследования. Моча: после тщательного туалета наружных половых органов в стерильный контейнер собирают среднюю порцию утренней свободно выпущенной мочи в количестве 5–10 мл. Учитывая, что содержащиеся в моче микроорганизмы при комнатной температуре начинают размножаться, образец должен быть доставлен в лабораторию в течение 1–2 ч, чтобы избежать ложных результатов при количественной оценке степени бактериурии. При невозможности выполнить это требование допускают хранение пробы мочи при температуре 4 °С в холодильнике не более 12 ч.
Кровь: посев крови (выявление бактериемии) необходим при подозрении на развитие синдрома системного воспаления. Стойкая гипертермия, озноб, гипотермия, лейкоцитоз, признаки полиорганной дисфункции служат категорическими показаниями для микробиологического исследования крови. Пробы крови берут как можно раньше, от начала лихорадки 2– 3 раза с интервалом 30–60 мин из периферических вен верхних конечностей (взятие крови на высоте лихорадки не повышает чувствительности метода, более важным для выявления этиологии заболевания становится оптимальный объём взятой крови). Оптимально использование стандартных коммерческих флаконов с готовыми питательными средами для культивирования аэробных микроорганизмов и строгих анаэробов. Особое внимание к соблюдению правил асептики: кожу в месте венепункции обрабатывают 1–2% раствором йода или повидонйода движениями от центра к периферии в течение не менее 1 мин. После обеззараживания пальпация места венепункции недопустима. Непосредственно перед пункцией вены кожу обрабатывают 70% раствором этанола. Манипуляцию проводят в стерильных перчатках. С флаконов снимают пластмассовые крышечки, резиновые пробки протирают 70% раствором этанола. После взятия крови из вены меняют иглу и, прокалывая резиновую пробку, вносят кровь во флакон (в каждый из двух флаконов около 10 мл крови). У детей до 1 года берут 0,5–1,0 мл крови в один флакон. У детей от 1 года до 6 лет общий объём забираемой крови составляет 1 мл на каждый год жизни, и этот объём распределяют между двумя флаконами. У детей и взрослых с массой тела от 30 до 80 кг 10–20 мл крови распределяют между двумя флаконами.
Взятие одной пробы из периферической вены, а другой из катетера допустимо только в исключительных случаях: при необходимости выявить катетерассоциированную бактериемию или при объективных трудностях, связанных с проведением венепункции.
МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ КЛИНИЧЕСКИХ ОБРАЗЦОВ
Важный этап микробиологического исследования как при диагностике ИППП, так и оппортунистических инфекций. Позволяет дать предварительную оценку качественному и количественному составу микрофлоры в патологическом очаге, оценить качество взятия материала (соответствие его очагу воспаления, например присутствие вагинального эпителия в мазках, взятых из цервикального канала, свидетельствует о нарушении правил отбора биопробы), а также выявить микроорганизмы, не растущие на обычных питательных средах (гонококки, трихомонады, строго анаэробные бактерии).
Чувствительность метода световой микроскопии находится на уровне выявления микроорганизмов в количестве 4– 5 lg КОЕ/мл и более. Поэтому этиологически значимые микроорганизмы в ряде случаев могут быть обнаружены уже при микроскопии. Это в первую очередь относится к строго анаэробным бактериям, обычно с низкими патогенными возможностями, их этиологическая роль проявляется при высоком количественном уровне после накопления в очаге инфекции. Учитывая своеобразие морфологии многих видов строгих анаэробов (бактероидыпревотеллы, фузобактерии, мобилункус, вейлонеллы, лептотрихии), а также микроаэрофила гарднереллы, обнаружение их в окрашенных по Граму мазках отделяемого влагалища служит доказательством их этиологической роли. Принципиально важной становится микроскопия мазков вагинального отделяемого при диагностике бактериального вагиноза и других вагинальных инфекций.
Однако большинство факультативно анаэробных УПМ не имеют морфологического своеобразия, а степени их патогенности и чувствительность к антибиотикам, напротив, чрезвычайно разнообразна. Поэтому для этой группы УПМ становится необходимым культуральное исследование. Кроме диагностики бактериального вагиноза, микроскопический метод имеет преимущество перед культуральным исследованием при диагностике относительно редких в репродуктивном возрасте состояний вагинальной микроэкологии: цитолитического вагиноза, промежуточной формы микроценоза, вагинальной эпителиальной атрофии (последняя характерна для возраста менопаузы).
Диагностика кандидозного вульвовагинита чаще всего может быть осуществлена при микроскопии мазка отделяемого влагалища по обнаружению в окрашенных или нативных мазках элементов гриба: почкующихся дрожжевых клеток, фрагментов псевдомицелия с бластоспорами. Обнаружение в мазках элементов гриба свидетельствует об их большом количестве (более 4–5 lg КОЕ/мл) и чаще всего сопровождается выраженной лейкоцитарной реакцией в вагинальном мазке и клиническими проявлениями воспалительного процесса во влагалище, что достаточно для подтверждения клинического диагноза вагинального кандидоза.
При лабораторной диагностике гонореи в первую очередь проводят микроскопию мазков, взятых из уретры и цервикального канала (если нет показаний для обследования других локусов: глотки, конъюнктив, прямой кишки). Следует стараться сделать параллельно по 2 мазка из каждого локуса для окраски синькой и по Граму. Для острой гонореи характерно отсутствие или скудное количество представителей нормальной микрофлоры (лактобацилл), большое количество нейтрофильных лейкоцитов и наличие грамотрицательных диплококков, расположенных внутри лейкоцитов (с явлением незавершённого фагоцитоза) и вне лейкоцитов. Для хронической гонореи характерно наличие разнообразной микрофлоры наряду с грамотрицательными диплококками вне и внутри лейкоцитов и большое количество нейтрофилов. Чаще всего диагноз гонореи может быть установлен на основании микроскопии мазков, окрашенных по Граму. Однако у беременных, подростков и детей обязательно культуральное исследование с видовой идентификацией Neisseria gonorrhoeae для дифференцирования от непатогенных нейссерий, которые признают компонентом нормальной влагалищной микрофлоры у девочек, а в случаях взятия материала из ротоглотки следует помнить о большом количестве видов непатогенных нейссерий в этих мазках в любом возрасте.
Микроскопический метод остаётся в настоящее время основным в диагностике урогенитального трихомониаза. Проводят исследование нативного препарата и/или окрашенного мазка. При микроскопии нативного препарата важно помнить, что исследованию подлежит свежевзятый материал (отделяемое уретры, влагалища) — в препарате выявляют живые, подвижные трихомонады. Для этого готовят препарат по методу «раздавленной» капли (взятое отделяемое с добавлением тёплого, близкого к температуре тела 0,9% раствора натрия хлорида накрывают покровным стеклом) или «висячей» капли (суспензию из взятых выделений помещают в лунку предметного стекла) и микроскопируют при увеличении в 400 раз при опущенном конденсоре. Из этого же материала готовят препараты для окраски метиленовым синим, по Граму или по Романовскому–Гимзе. Диагноз устанавливают на основании выявления в мазках типичных форм влагалищных трихомонад.
При оценке результатов микроскопии влагалищных мазков следует обращать внимание на следующие моменты:
- состояние вагинального эпителия: преобладают клетки поверхностного, промежуточного или парабазального слоя; наличие так называемых «ключевых» клеток — поверхностных эпителиальных клеток, густо покрытых адгезированными на них мелкими грамвариабельными палочками, скрывающими границы клетки (рис. 6-1), или «ложноключевых» клеток — повышенная адгезия на эпителиальных клетках грамположительных палочек, чаще всего лактобацилл (рис. 6-2);
- лейкоцитарную реакцию: её наличие, степень выраженности, проявления фагоцитоза, его завершённость;
- состав микрофлоры: количественная и качественная оценка по морфотипам и тинкториальным свойствам.
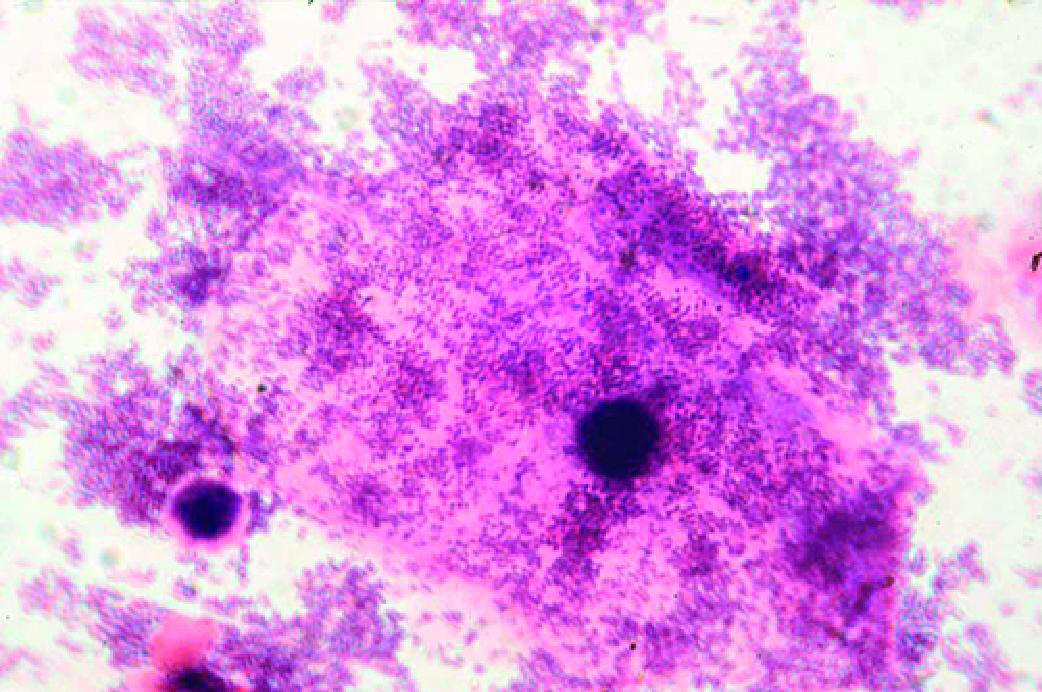
Рис. 6-1. «Ложноключевые» клетки (микроскопия мазка, окрашенного по Граму).
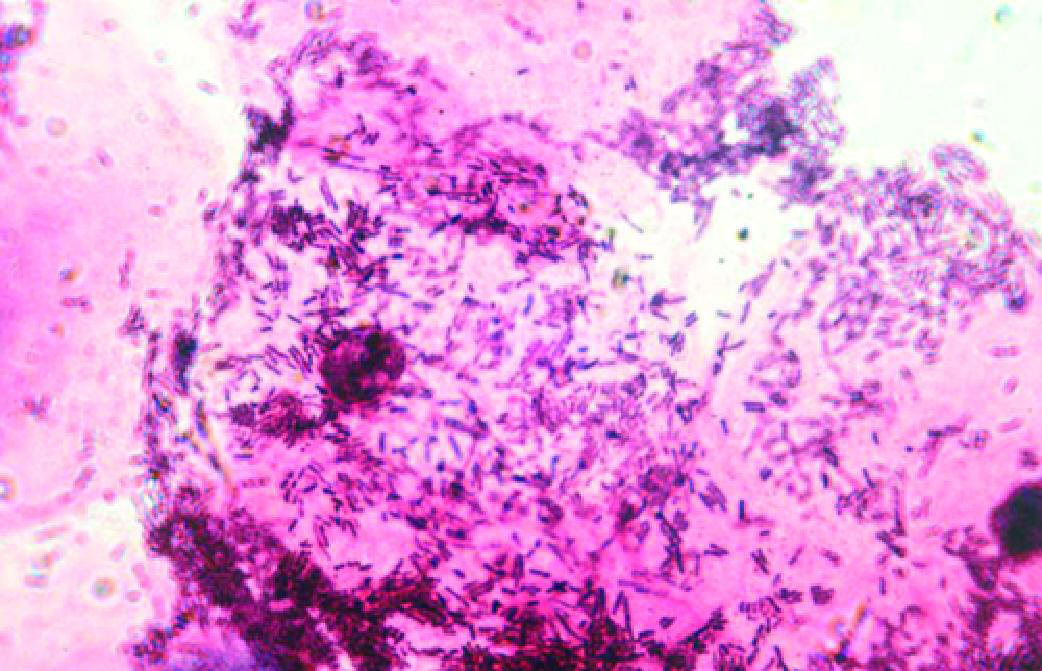
Рис. 6-2. Нормоценоз (микроскопия мазка, окрашенного по Граму). Оценку общей микробной обсеменённости проводят по 4-балльной системе (критерии Nugent, несколько видоизменённые нами) — по числу микробных клеток, обнаруживаемых в одном поле зрения при микроскопии с иммерсией:
+ — до 10 микробных клеток в поле зрения — минимальное количество;
++ — от 11 до 100 микробных клеток в поле зрения — умеренное количество;
+++ — от 100 до 1000 микробных клеток в поле зрения — большое количество;
++++ — более 1000 микробных клеток в поле зрения — массивное количество.
Качественная оценка микрофлоры влагалища включает дифференциацию всех морфотипов по их тинкториальным свойствам и морфологическим признакам. Различают морфотипы лактобацилл, фузобактерий, бактероидов, мобилункусов, лептотрихий, вейлонелл, гарднерелл, а также грамположительных кокков, колиформных палочек, дрожжевых грибов. В мазке могут быть обнаружены трихомонады и другие паразиты.
При подозрении на сифилис не потеряли своего диагностического значения тёмнопольная микроскопия отделяемого эрозий и язв и метод прямой иммунофлюоресценции с использованием АТдиагностикумов к Т. pallidum. Эти методы используют в случаях с клиническими проявлениями на коже и слизистых оболочках, подозрительными на сифилис. Кроме того, препараты для микроскопии можно приготовить из пунктатов регионарных лимфатических узлов, спинномозговой жидкости, амниотической жидкости. Эрозивноязвенную поверхность осторожно (чтобы не получить кровотечения) очищают с помощью марлевого тампона, увлажнённого 0,9% раствором натрия хлорида, затем, осторожно сжимая и разжимая двумя пальцами основание язвы/эрозии, стимулируют выделение серозного экссудата, который берут бактериологической петлёй или аккуратно прикладывая к эрозивной поверхности предметное стекло. Полученное серозное отделяемое смешивают с равным количеством 0,9% раствора натрия хлорида, накрывают покровным стеклом и микроскопируют нативный препарат для обнаружения возбудителя по ряду характерных морфологических признаков и виду движений. Требуется определённый опыт, чтобы дифференцировать при микроскопии бледную трепонему от трепонемкомменсалов урогенитального тракта.
Более объективной может быть диагностика при микроскопии препаратов с помощью прямой иммунофлюоресценции. В этих случаях взятое на предметное стекло отделяемое из любых тканевых жидкостей, поверхностей патологических участков (в том числе аутопсийного материала) высушивают на воздухе, фиксируют этанолом или метанолом. После этого на препарат наносят специфический к Т. pallidum антитрепонемный глобулин. При микроскопии препарата возбудитель выявляют по яркозелёной специфической флюоресценции.
Иммунолюминесцентный метод — основной и в лабораторной диагностике ГГ, при этом в препарате из патологического материала выявляют Аг вируса. Обычно используют метод прямой иммунофлюоресценции, позволяющий определять как оба типа ВПГ, так и отдельно серотипы ВПГ1 и ВПГ2. Чувствительность и специфичность метода зависят от качества используемых диагностикумов. Материалом для исследования обычно служат жидкость из вскрытых пузырьков, отделяемое эрозивных поверхностей кожи и слизистых оболочек или соскоб со стенок цервикального канала (при латентной форме инфекции). Материал берут бактериологической петлёй или специальным тампоном и переносят на предметное стекло.
При урогенитальном хламидиозе выявление Аг хламидий с помощью иммунофлюоресцентной микроскопии служит одним из ведущих лабораторных методов диагностики. Обычно используют прямую иммунофлюоресценцию, при проведении которой применяют моноклональные АТ к разным Аг хламидий — липополисахаридному (групповому), основному белковому видовому Аг наружной мембраны хламидий, а также АТ к рекомбинантным Аг хламидий. Качество диагностикумов определяет степень чувствительности метода. Большое значение при оценке результатов прямой иммунофлюоресценции имеет качество взятия материала: в мазке на стекле пробы, взятой из цервикального канала, должны присутствовать цилиндрические эпителиальные клетки и отсутствовать клетки плоского эпителия, эритроциты и лейкоциты. Результат считают положительным, если в мазках отделяемого с помощью люминесцентного микроскопа на оранжевокоричневом фоне эпителиальных клеток обнаруживают не менее 5 элементарных телец при увеличении 100 крат. Изза возможных ложноположительных результатов этот метод не рекомендуют для исследования материалов, полученных из носоглотки и прямой кишки.
КУЛЬТУРАЛЬНОЕ ИССЛЕДОВАНИЕ
Метод посева и выделения чистых культур возбудителей заболевания служит «золотым стандартом» микробиологической диагностики. Культуральное исследование наряду с микроскопией — основной метод при диагностике гонореи, трихомониаза, хламидиоза. Методы молекулярнобиологического исследования пока недостаточно специфичны для выявления этих возбудителей ИППП, чтобы вытеснить классические методы, но, несомненно, им принадлежит будущее. Другая ситуация сложилась с оппортунистическими инфекциями половых путей, число которых в эру антибиотиков и урбанизации жизни общества неуклонно увеличивается, динамично меняется их этиологическая структура и чувствительность к антибиотикам. Частая антибиотикорезистентность этих микроорганизмов становится причиной неэффективности лечения, поэтому адекватный выбор рациональной этиотропной терапии в современных условиях признают постоянной клинической проблемой.
Известно, что возбудителями воспалительных процессов половых органов могут быть разнообразные УПМ, в норме входящие в состав транзиторного компонента индигенной (нормальной) микрофлоры влагалища и прилегающих биотопов. Их патогенные свойства проявляются лишь в определённых условиях нарушения иммунного гомеостаза макроорганизма и местной колонизационной резистентности. В этих условиях микробиологическая диагностика должна учитывать возможную этиологическую роль широкого круга патогенов, а не только какоголибо конкретного возбудителя, как при диагностике классических инфекционных заболеваний, вызываемых абсолютными патогенами. Задачей исследования становится не только идентификация микроорганизмов, обнаруженных в патологическом материале, но и обоснование их этиологической роли в воспалительном процессе у данной больной. Поэтому при посеве клинического материала, особенно из локусов, и в норме имеющих микрофлору, очень важно использовать наиболее универсальные питательные среды, которые пригодны для культивирования широкого круга микроорганизмов. При этом необходимо учитывать количественные соотношения роста различных видов микроорганизмов в первичном посеве, так как истинному возбудителю чаще всего принадлежит превалирующая роль среди ассоциантов. Однако есть виды, которые и в небольшом количестве проявляют патогенные свойства (стрептококки групп А и В, протеи, клебсиеллы, золотистый стафилококк, листерии и др.).
Микробиологическая диагностика оппортунистических инфекций влагалища базируется на интегральной оценке результатов микроскопического и культурального исследований. При этом строго анаэробный компонент микрофлоры оценивают по микроскопии граммазков — большое количество анаэробных морфотипов, выявляемых при световой микроскопии (их количество в отделяемом влагалища превышает 6 lg КОЕ/мл), свидетельствует об их этиологической роли. При этом определение чувствительности анаэробов к антибиотикам в настоящее время не имеет клинической целесообразности, так как в подавляющем большинстве они высокочувствительны к антибиотикам с антианаэробной активностью (клиндамицин, метронидазол).
Напротив, что касается факультативноанаэробных и аэробных микроорганизмов, то диагностическая ценность микроскопического исследования вагинального отделяемого значительно снижается. Это связано, вопервых, с тем, что патогенные возможности этих бактерий могут проявляться при сравнительно небольшом (3–5 lg КОЕ/мл) их количестве, которое не выявляют при микроскопии. Вовторых, даже если морфотипы факультативноанаэробных бактерий обнаруживают в граммазках, морфологически они однотипны у многих видов и родов бактерий (это колиформные палочки или грамположительные кокки). В то же время их патогенные свойства и чувствительность к антибиотикам могут быть весьма разнообразными. Поэтому для характеристики факультативноанаэробной части микроценоза, а также микроаэрофилов (в первую очередь лактобацилл), которые по морфологии могут быть сходными с многими видами облигатноанаэробных бактерий (клостридии, эубактерии, пропионибактерии и др.), необходимо культуральное исследование — посев вагинального отделяемого. Для этих целей используют 5% кровяной агар (наиболее универсальная среда для большинства УПМ), агар Сабуро (для выделения грибов), среду МРС (для культивирования лактобацилл).
Результаты культурального исследования дают возможность оценить видовой состав и количественное соотношение различных видов в ассоциации микроорганизмов, в том числе грибов, а также лактобацилл, и тем самым подтвердить принадлежность к роду лактобацилл тех лактоморфотипов, которые были обнаружены при микроскопии граммазков. Выделение из патологического материала и идентификация различных видов семейства Enterobacteriaceae, стафилококков, стрептококков, неферментирующих бактерий, нейссерий, коринебактерий, грибов и других микроорганизмов после количественной оценки их роста позволяет определить степень их этиологической значимости в развитии вагинита у конкретной пациентки.
Кроме того, в случаях когда диагноз бактериального вагиноза установлен при микроскопии грамотрицательного мазка, результаты посева могут выявить повышенные титры УПМ (грибы, энтерококки, колиформные и другие бактерии), которые могут стать причиной осложнений после этиотропной терапии препаратами с антианаэробной активностью. Особенно следует иметь в виду микроорганизмы, которые даже в низких концентрациях служат фактором повышенного риска для внутриутробного плода (листерии, стрептококки групп А и В).
Методы идентификации нуклеиновых кислот
Методы выявления ДНК и РНК-возбудителей в настоящее время применяют в основном для диагностики вирусных инфекций. Методы генной диагностики базируются на выявлении нуклеотидных последовательностей непосредственно в патологическом материале с помощью молекулярных зондов — искусственно полученных нуклеиновых кислот, комплементарных вирусным нуклеиновым кислотам и меченных биотином или радиоактивной меткой.
Особенность метода ПЦР — многократное копирование (амплификация, репликация) с помощью фермента ДНКполимеразы определённого фрагмента ДНК, состоящего из нескольких десятков или сотен нуклеотидных пар, который уникален, то есть специфичен для данного вида вирусавозбудителя. Механизм репликации таков, что достраивание фрагмента может начаться только в определённых стартовых блоках, для создания которых в заданных участках ДНК
используют затравки (праймеры) — специально синтезированные олигонуклеотиды. Праймеры комплементарны последовательностям в пределах границ специфического фрагмента, и синтез ДНК протекает только в этих границах.
Процесс ПЦР заключается в большом числе циклов синтеза (амплификации) специфического фрагмента ДНК, накоплении большого числа копий, которые затем могут быть выявлены обычными методами детекции (иммунофлюоресцентный анализ, электрофорез).
Преимущества ПЦРдиагностики:
●простота исполнения;
●возможность полной автоматизации;
●быстрота получения результата;
●малое количество патологического материала, необходимого для исследования;
●возможность диагностики острых, хронических, латентных инфекций;
●выявление некультивируемых, персистирующих форм патогенов.
По чувствительности ПЦР наиболее совершенен как диагностический метод (на несколько порядков выше, чем другие тесты). Специфичность метода также высока, но пока большинство тестсистем недостаточно надёжны, чтобы вытеснить классические методики при диагностике даже абсолютных патогенов.
Что касается оппортунистических инфекций, то значение молекулярно-генетических методов диагностики пока нельзяпризнать сколько-нибудь значимыми, так как определяющим моментом в развитии таких воспалительных процессов служит количественный фактор, а не само по себе присутствие микроорганизма в обследуемом локусе.
В настоящее время ПЦР-методы широко используют в диагностике вирусных, паразитарных и бактериальных ИППП, чаще в качестве первичного скрининга, а также контроля излеченности в сочетании с другими методами лабораторной диагностики. С помощью новейших технологий, таких как ПЦР в режиме реального времени и метода NASBA, можно определить точное количество вируса у ВИЧпациентов.
СЕРОЛОГИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ
Методы, выявляющие специфические АТ и Аг возбудителей. Важна их роль особенно в тех случаях, когда выделение возбудителя представляет значительные трудности. При выявлении специфических АТ необходимо установить повышение их титров, в связи с чем исследуют парные сыворотки с интервалом 2–3 нед. Определение классов иммуноглобулинов чётко характеризует этапы инфекционного процесса и в ряде случаев может служить прогностическим признаком его течения.
Большое значение имеют методы выявления Аг возбудителей. Их можно обнаружить уже на самых ранних этапах инфекционного процесса, что делает возможной экспрессдиагностику, а количественное определения Аг в динамике заболевания служит критерием эффективности проводимого лечения.
Ведущее значение приобрели серологические методы в диагностике сифилиса и ВИЧинфекции. В диагностике ВИЧинфекции обычно используют иммуноферментный анализ, позволяющий получить положительные результаты исследования уже через 1–1,5 мес после заражения. Положительные результаты скрининга с использованием иммуноферментного анализа требуют подтверждения методом иммуноблота, который позволяет верифицировать АТ к различным вирусным белкам.
При диагностике сифилиса в настоящее время используют разнообразные серологические методы, позволяющие выявлять в организме АТ к различным Аг детерминантам T. pallidum. В зависимости от используемого Аг серологические реакции делят на две группы: трепонемные и нетрепонемные. Первые используют для скрининга. Они технически просты в исполнении, не требуют много времени, возможен количественный вариант реакции с определением титра АТ, что позволяет использовать их для оценки эффективности проводимого лечения. Однако эти тесты не позволяют обнаружить АТ в первые 2–4 нед первичного сифилиса, а также возможны ложноположительные и ложноотрицательные реакции.
Трепонемные тесты обладают высокой специфичностью и позволяют подтвердить результаты нетрепонемных тестов. Но трепонемные тесты оказались недостоверными при исследовании спинномозговой жидкости (кроме реакции прямой гемагглютинации), их также не используют в качестве контроля эффективности лечения и не исключена возможность ложноположительных реакций.
При оппортунистических бактериальных инфекциях, возбудители которых имеют много общих Аг с тканевыми Аг организма хозяина и служат слабыми стимуляторами выработки специфических АТ, серологические методы диагностики практически не используют.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ МИКРОБИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
ОЦЕНКА РЕЗУЛЬТАТОВ МИКРОБИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ОТДЕЛЯЕМОГО ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ
При оценке результатов микробиологического исследования отделяемого женских половых органов необходимо учитывать совокупность признаков в каждом конкретном случае: данные микроскопии первичных мазков исследуемого материала, результаты прямого посева на плотные питательные среды (количественная оценка роста различных видов), а также клиническую симптоматику заболевания и анамнез больной. Так, при исследовании материала из закрытых полостей (пунктаты опухолевидных образований в малом тазу, околоплодные воды), а также органов, в норме стерильных (содержимое полости матки, соскоб эндометрия, кусочки органов и тканей, удаляемых при оперативном вмешательстве), рост микроорганизмов, особенно в монокультуре, свидетельствует об их этиологической роли. При исследовании материала из локусов, и в норме имеющих разнообразную микрофлору, большое значение придают оценке видового состава, количественной оценке роста различных видов, выросших при первичном посеве, однотипности результатов при повторных исследованиях, а также клиническим данным. На основании интегральной оценки результатов микроскопии и культурального исследования отделяемого влагалища могут быть предложены следующие микробиологические критерии оценки состояния микроценоза влагалища по отдельным нозологическим формам у женщин репродуктивного возраста.
НОРМОЦЕНОЗ
- Микроскопия мазка, окрашенного по Граму (рис. 6-3):
♦вагинальный эпителий представлен клетками поверхностных слоёв, реже встречают клетки промежуточного слоя
(соотношение может меняться в зависимости от фазы менструального цикла, у беременных много промежуточных клеток),
«ключевые» клетки отсутствуют, иногда встречают «ложноключевые» клетки;
♦лейкоцитарная реакция отсутствует или слабо выражена — единичные лейкоциты в поле зрения;
♦общее количество микроорганизмов умеренное или большое;
♦доминирующий морфотип — лактобациллы, другие морфотипы либо отсутствуют, либо их количество исчисляется
единичными микробными клетками в редких полях зрения. - Культуральное исследование:
♦общая микробная обсемененность — 6–8 lg КОЕ/мл;
♦абсолютное преобладание лактобацилл;
♦УПМ в низком титре (менее 3 lg КОЕ/мл) или отсутствуют.
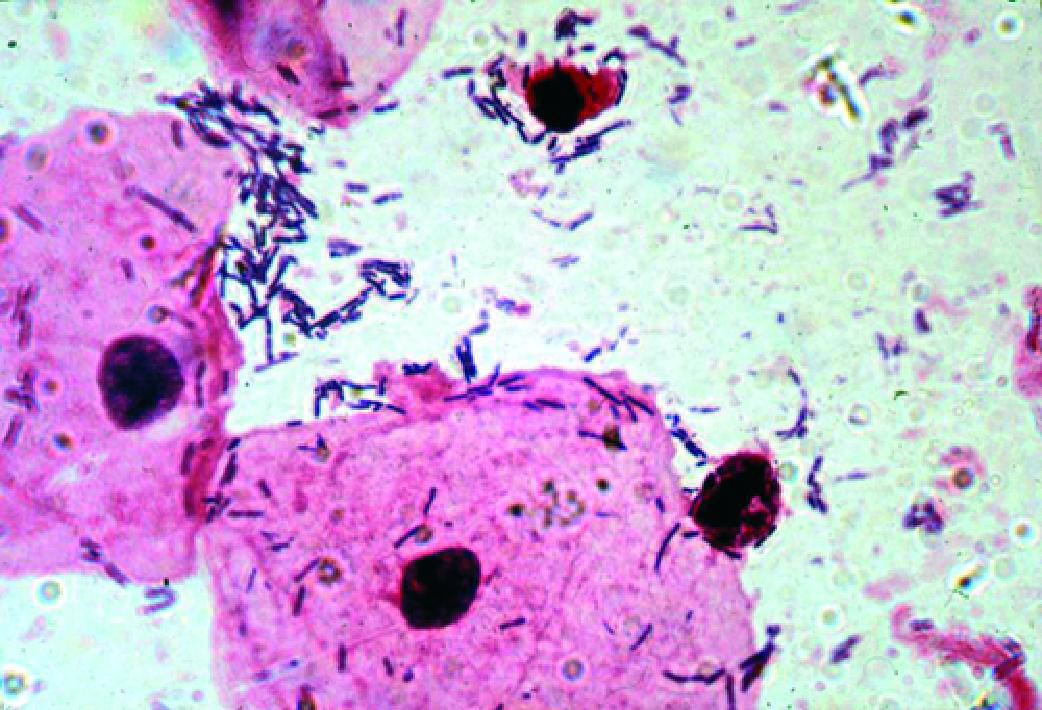
Рис. 6-3. «Ключевые» клетки (микроскопия мазка, окрашенного по Граму).
БАКТЕРИАЛЬНЫЙ ВАГИНОЗ
- Микроскопия мазка, окрашенного по Граму (рис. 6-4):
♦вагинальный эпителий представлен клетками поверхностных слоёв, редко встречают промежуточные клетки, часто — «ключевые» клетки;
♦лейкоцитарная реакция, как правило, отсутствует;
♦общее количество микроорганизмов массивное, реже — большое;
♦преобладают морфотипы строгих анаэробов и гарднереллы, лактоморфотипы отсутствуют или определяются как единичные не во всех полях зрения. - Культуральный метод:
♦общая микробная обсеменённость превышает 9 lg КОЕ/мл; полимикробный характер микрофлоры с абсолютным преобладанием облигатно анаэробных видов и гарднереллы;
♦при использовании только аэробных условий культивирования рост микроорганизмов отсутствует или наблюдают рост УПМ, чаще в небольшом титре;
♦отсутствует рост лактобацилл или их титр резко снижен (менее 5 lg КОЕ/мл).
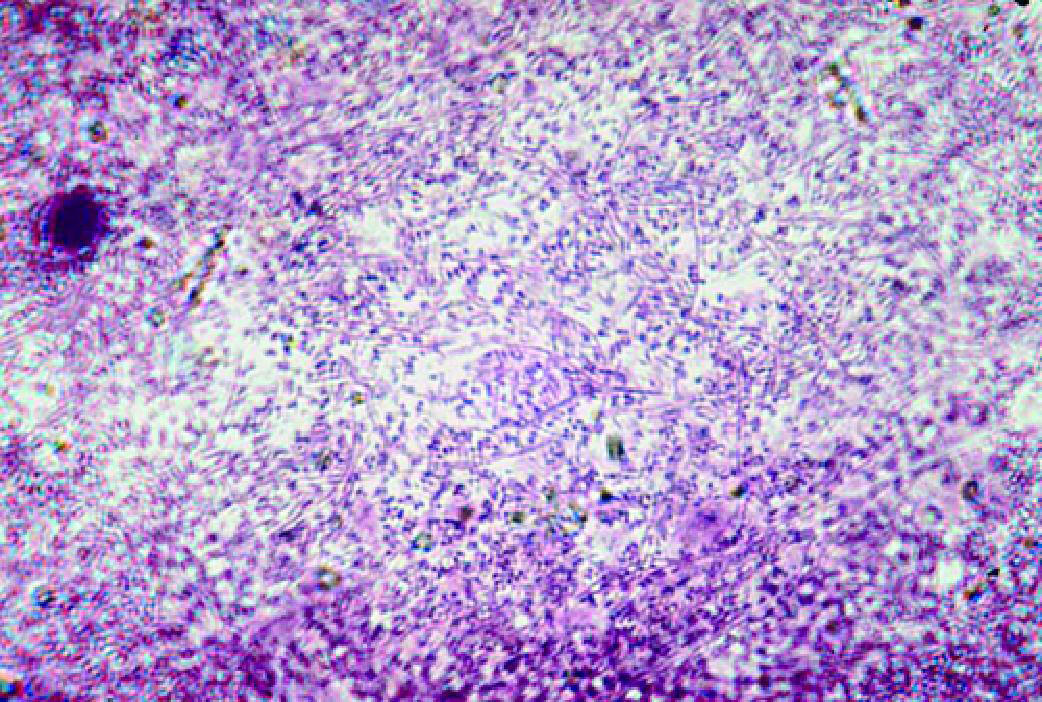
Рис. 6-4. Бактериальный вагиноз (микроскопия мазка, окрашенного по Граму).
ВАГИНАЛЬНЫЙ КАНДИДОЗ
В зависимости от концентрации грибов в отделяемом влагалища и сопутствующей микрофлоры можно выделить 3 формы кандидозной инфекции влагалища.
Кандидозный вагинит.
- Микроскопия мазков, окрашенных по Граму (рис. 6-5):
♦вагинальный эпителий преимущественно поверхностных слоёв, но может быть много промежуточных и даже парабазальных клеток (пропорционально степени тяжести клинического течения заболевания);
♦лейкоцитарная реакция от умеренной (10–15 лейкоцитов в поле зрения) до резко выраженной (30–50 и более лейкоцитов в поле зрения);
♦общее количество микроорганизмов умеренное или большое;
♦доминируют морфотипы лактобацилл, присутствуют дрожжевые клетки, фрагменты псевдомицелия с бластоспорами. - Культуральный метод:♦общее количество микроорганизмов не превышает 8 lg КОЕ/мл;
♦дрожжевые грибы присутствуют в титре более 4 lg КОЕ/мл;
♦лактобациллы высевают в титре более 6 lg КОЕ/мл.
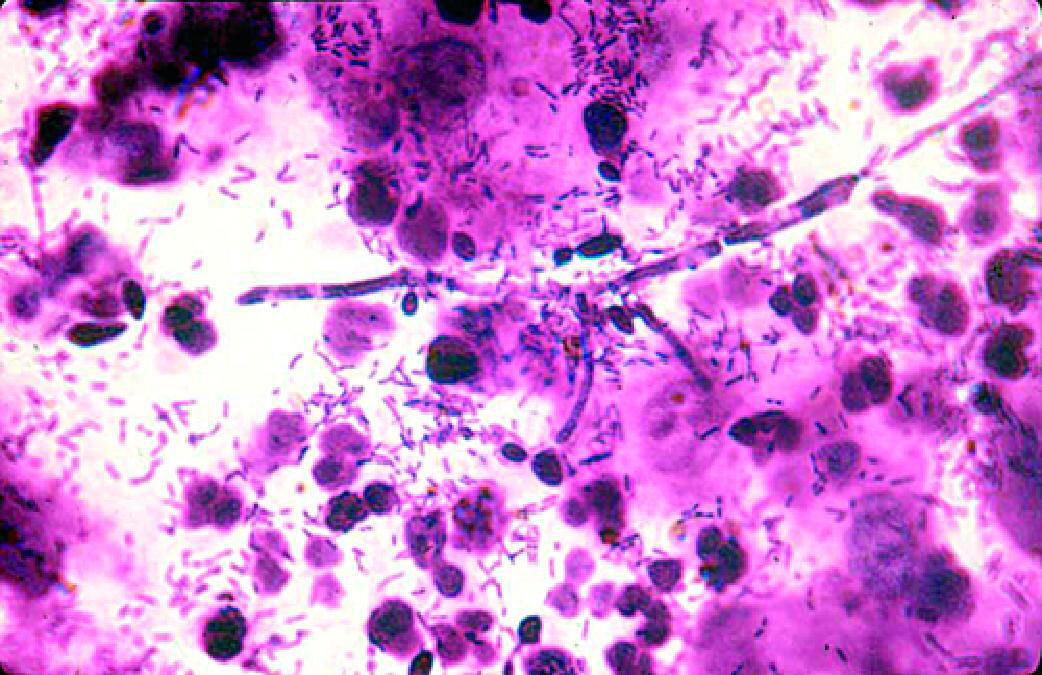
Рис. 6-5. Кандидозный вагинит (микроскопия мазка. окрашенного по Граму).
Сочетание бактериального вагиноза и кандидозного вагинита.
- Микроскопия мазка, окрашенного по Граму (рис. 6-6):
♦вагинальный эпителий преимущественно поверхностных слоёв, присутствуют «ключевые» эпителиальные клетки;
♦умеренная или выраженная лейкоцитарная реакция;
♦общее количество микроорганизмов массивное или большое;
♦доминируют морфотипы строгих анаэробов и гарднереллы, присутствуют дрожжевые клетки и/или фрагменты псевдомицелия гриба;
♦лактоморфотипы отсутствуют или видны единичные в поле зрения. - Культуральный метод:
♦общее количество микроорганизмов массивное (более 9 lg КОЕ/мл), но при культивировании только в аэробных условиях отмечают рост лишь дрожжеподобных грибов в умеренном или высоком титре (4–7 lg КОЕ/мл);
♦рост лактобацилл отсутствует или их титр низкий (менее 4 lg КОЕ/мл);
♦доминирующие в посеве микроорганизмы — бактероиды, превотеллы, гарднерелла, анаэробные кокки.
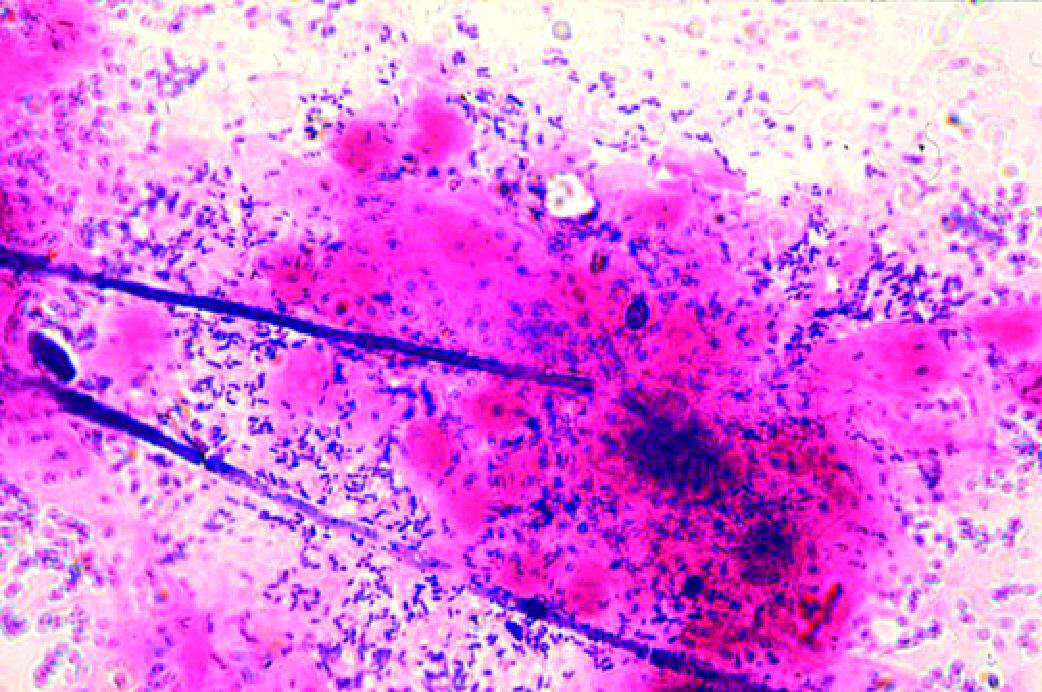
Рис. 6-6. Сочетание бактериального вагиноза и кандидозного вагинита (микроскопия мазка, окрашенного по Граму).
Бессимптомное носительство грибов.
- Микроскопия мазка, окрашенного по Граму:
♦вагинальный эпителий представлен преимущественно клетками поверхностных слоёв;
♦лейкоцитарная реакция не выражена, единичные лейкоциты в поле зрения;
♦общее количество микроорганизмов умеренное или большое;
♦доминируют морфотипы лактобацилл, грибы чаще всего не выявляют или встречают в редких полях зрения единичные дрожжевые клетки. - Культуральный метод:
♦общее количество микроорганизмов не превышает 8 lg КОЕ/мл;
♦доминируют
НЕСПЕЦИФИЧЕСКИЙ ВАГИНИТ
Микроскопия мазка, окрашенного по Граму (рис. 6-7):
♦вагинальный эпителий представлен поверхностными и промежуточными клетками, при выраженном воспалительном процессе встречают парабазальные клетки;
♦выражена в разной степени лейкоцитарная реакция (более 10 лейкоцитов в поле зрения);
♦общее количество микроорганизмов умеренное;
♦лактобациллы отсутствуют или их количество резко снижено (до единичных в поле зрения);
♦преобладают морфотипы УПМ — колиформные палочки или грамположительные кокки.
Культуральный метод:
♦отсутствие роста лактобацилл или их минимальное количество;
• рост факультативноанаэробных УПМ, чаще всего одного вида в высоком титре.
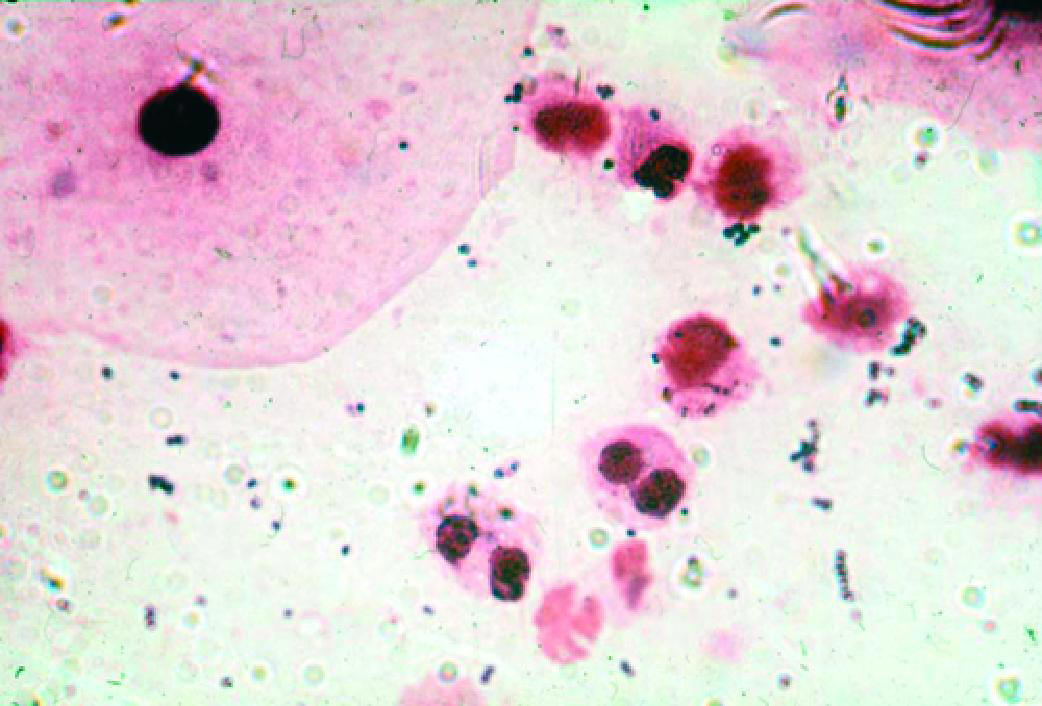
Рис. 6-7. Неспецифический вагинит (микроскопия мазка, окрашенного по Граму).
ПРОМЕЖУТОЧНЫЙ ВАРИАНТ МИКРОЦЕНОЗА
- Микроскопия мазка, окрашенного по Граму:
♦вагинальный эпителий представлен поверхностными клетками, можно встретить единичные «ключевые» клетки или
наблюдать склонность к их формированию;
♦количество лейкоцитов не более 10 в поле зрения;
♦общее количество микроорганизмов умеренное или большое;
♦доминируют морфотипы строгих анаэробов и гарднереллы в сочетании с умеренно сниженным титром лактобацилл. - Культуральный метод:
♦общее количество микроорганизмов 6–8 lg КОЕ/мл;
♦титр лактобацилл снижен, но может достигать умеренных величин (5–6 lg КОЕ/мл);
♦умеренный титр облигатных анаэробов и гарднереллы (5–7 lg КОЕ/мл).
ЦИТОЛИТИЧЕСКИЙ ВАГИНОЗ
- Микроскопия мазка, окрашенного по Граму (рис. 6-8):
♦эпителиальные клетки в подавляющем большинстве подвергнуты цитолизу; в мазке преобладают элементы деструкции
клеток — детрит, обнажённые ядра поверхностных и промежуточных клеток;
♦лейкоциты отсутствуют или их количество не превышает 10 в поле зрения;
♦микрофлора в большом количестве, представлена морфотипами типичных лактобацилл. - Культуральный метод:
♦обильный рост только лактобацилл;
♦сопутствующая микрофлора, как правило, отсутствует.
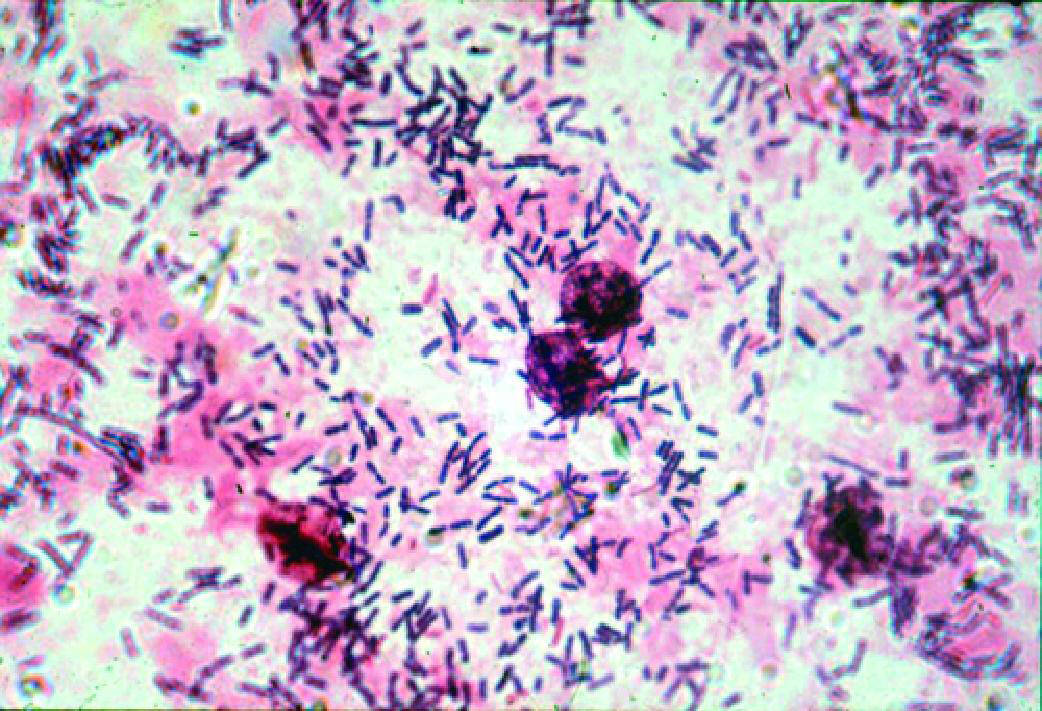
Рис. 6-8. Цитолитический вагиноз (микроскопия мазка, окрашенного по Граму).
ВАГИНАЛЬНАЯ ЭПИТЕЛИАЛЬНАЯ АТРОФИЯ
- Микроскопия мазка, окрашенного по Граму (рис. 6-9):
♦в зависимости от степени атрофии слизистой оболочки влагалища эпителий представлен различным соотношением числа промежуточных и парабазальных клеток, по мере нарастания атрофии увеличивается число парабазальных и базальных клеток;
♦количество лейкоцитов обычно не превышает 10 в поле зрения;
♦микрофлора практически отсутствует; можно встретить единичные лактоморфотипы или морфотипы УПМ в редких полях зрения. - Культуральный метод:
♦низкая общая микробная обсеменённость (2–4 lg КОЕ/мл);
♦низкие титры как лактобацилл, так и УПМ.
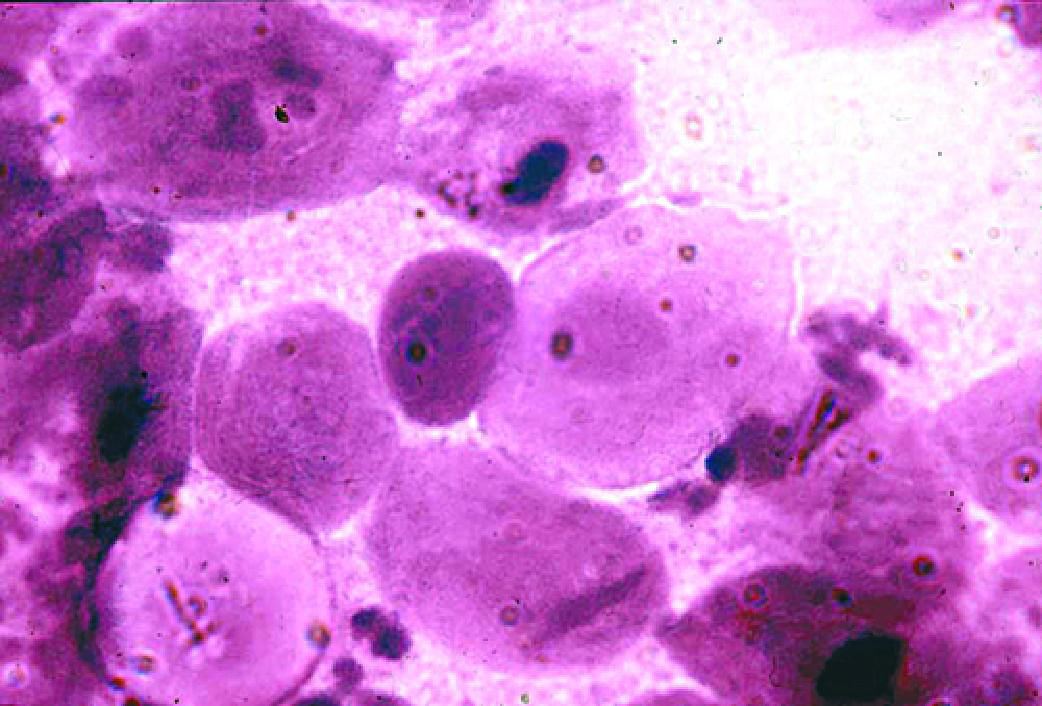
Рис. 6-9. Вагинальная эпителиальная атрофия (микроскопия мазка, окрашенного по Граму).
ОЦЕНКА РЕЗУЛЬТАТОВ МИКРОБИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ КРОВИ
При выделении типичных патогенов (золотистый стафилококк, листерии, клебсиелла, другие колиформные бактерии, синегнойная палочка), а также грибов диагностическую значимость имеет даже одна положительная гемокультура. При выделении микроорганизмов, которые признаны кожными сапрофитами (коагулазоотрицательные стафилококки, дифтероиды, микрококки) для подтверждения истинной бактериемии требуется две положительные гемокультуры.
ОЦЕНКА РЕЗУЛЬТАТОВ МИКРОБИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ МОЧИ
Степень бактериурии — главный критерий при дифференциации инфекционного процесса в мочевых путях от контаминации мочи нормальной микрофлорой. Степень бактериурии, не превышающая 3 lg КОЕ/мл, обычно результат контаминации. Степень бактериурии 3–4 lg КОЕ/мл расценивают как сомнительный результат и исследование необходимо повторить. Степень бактериурии, равная и выше 5 lg КОЕ/мл, указывает на наличие воспалительного процесса. Однако
необходимо учитывать особенности клинических проявлений заболевания и проводимую терапию (не только антибактериальную). Например, при плохом пассаже мочи, при её низкой относительной плотности, при рН встречают в моче здоровых людей. Монокультура чаще характерна для острых воспалительных процессов, и она сочетается с высокой степенью бактериурии. Ассоциации микроорганизмов чаще встречают при хронических процессах. При окончательной оценке результатов микробиологического исследования мочи необходимо учитывать данные клинической картины и других лабораторных исследований.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕЗУЛЬТАТ
Достоверность микробиологической диагностики в первую очередь зависит от соблюдения врачомклиницистом правил взятия патологического материала для исследования и полноценности сведений о состоянии обследуемой пациентки, так как от этих данных зависят выбор тактики микробиологического исследования и интерпретация полученных результатов. Необходимо соблюдать следующие требования при взятии и транспортировке биоматериала для микробиологического
исследования:
●брать материал из очага инфекции (где возбудитель находится в максимальном количестве), а при невозможности выполнить это требование, брать биопробы, связанные с очагом инфекции (моча при патологии почек и мочевого пузыря, отделяемое из цервикального канала при эндометрите);
●отделяемое из влагалища, цервикального канала, уретры брать до проведения мануального влагалищного исследования; удостовериться, что пациентка не использовала местного лечения по крайней мере в течение последних 3 сут;
●брать материал до начала антимикробной терапии, а при невозможности выполнить это требование — непосредственно перед введением следующей дозы препарата (когда концентрация его становится минимальной);
●соблюдать правила асептики, т.е. не допускать контаминации забираемой пробы сопутствующей транзиторной микрофлорой;
●использовать для взятия пробы стерильные ватные (дакроновые) тампоны и транспортные среды (отделяемое влагалища, цервикального канала, раневое отделяемое), контейнеры (моча, кал), шприцы (гной, экссудат), флаконы с питательными средами для посева крови; для экспрессдиагностики вирусных инфекций используют тампоныщётки, с которых биоматериал переносят на предметное стекло или помещают в специальные транспортные среды;
●транспортировку в лабораторию взятого материала проводить в адекватном температурном режиме (20–37 °С), в максимально короткие сроки (не более 1–1,5 ч); при невозможности выполнить это требование использовать транспортные среды и хранить пробы в условиях бытового холодильника (за исключением ликвора и крови);
●при подозрении на анаэробную инфекцию материал следует максимально защищать от кислорода воздуха; сразу после взятия помещать в анаэробные контейнеры или в специальные транспортные среды;
●при подозрении на гонорейную инфекцию предпочтительнее прямой посев взятого стерильной пластиковой петлёй материала на плотную селективную среду; затем чашку Петри с посевом помещают в специальный пластиковый пакет с повышенным содержанием углекислого газа и отправляют в лабораторию.
Среди факторов, влияющих на достоверность микробиологической диагностики, можно выделить:
●условия взятия и транспортировки биологического материала;
●адекватный выбор методов микробиологического исследования;
●профессиональную квалификацию врачамикробиолога;
●полноценность сведений о состоянии обследуемой пациентки, важных с точки зрения оценки полученных результатов.
Необходимо постоянно поддерживать контакт с лабораторией, проводить совместные обсуждения клиницистов и микробиологов для оперативного снятия претензий и вопросов друг к другу, периодически проводить анализ, оценку работы для её совершенствования.

